技术转移过程实施要点浅析
本文依据对国内外法规理念及要求的理解——对制药行业技术转移过程进行浅析和解读,以期为目前正在实施或即将实施技术转移的制药企业提供必要的借鉴和参考。
目前,制药行业各公司间以及公司内进行技术转移的情况日益增加,原因各种各样,主要包括:药厂排污对环境的污染现象日益突出及监管部门对环境严格治理、管理;加之新版GMP认证要求期限首轮结束[1],以及基本药物招标竞争激烈,制药企业的经营策略会发生变化,例如增加产能的需求、寻求新的生产场所、合并和收购或优化产品结构/整合资源以减少损失、降低风险。那么如何进行技术转移使其既能满足法规要求,又能确保产品质量符合注册且安全、有效,就成为制药企业非常关心的问题。
技术转移实施
技术转移实施时,无论转出方或接收方均需要从以下几个方面实施要点来考虑,以确保产品/分析程序顺利实施[2]。
技术转移小组
转移可能是在同一组织不同部门,也有可能是不同组织之间发生与工艺相关所有文件和专业技术的转移,并会涉及不同人员,其次是职责与理念或认知方面存在差异。
技术转移前需要成立转移小组,确定团队组织架构,并明确转移小组负责人、成员包括小组成员各自角色及职责。
转移小组成员应从转出方和接收方相关领域确定,如:研发、生产、质量控制(QC,Quality Control)、工程、质量保证(QA,Quality Assurance)、药政事务、财务等部门人员中选出小组成员与主题专家。小组成员应具备必要的资质和经验,以便管理转移过程中的不同方面。
技术转移章程
转移双方经过协商沟通形成章程,明确转移范围,如:产品/规程、转移协议、转移成功标准及可交付的成果、药政策略以及转移交流会议频次、沟通方式等。技术转移章程应由转出方与接收方负责人及利益相关方进行评审并批准,并应按变更管理规程进行管理。
定义项目总体范围,记录团队成员角色和职责,估计项目需要的付出与时间,建立成功标准并辨识重要的风险。确保利益相关方及转出方与接收方团队成员对项目正确理解,并商定可交付结果。
成功标准-标准应该是可测量并可实现的。有文件化的证据来证明接收方可以正常地再次展示所转移的产品、工艺或方法,并且符合与转出方协商的标准,则可以认为技术转移成功。通常可能包括:技术执行评价、项目时间及预算费用评价。
技术转移项目会牵涉到法律和经济方面,如:知识产权、版税、价格、利益和保密等,将会影响到技术问题的公开交流,转移双方应在计划和实施技术转移之前和过程中进行说明。
技术转移包
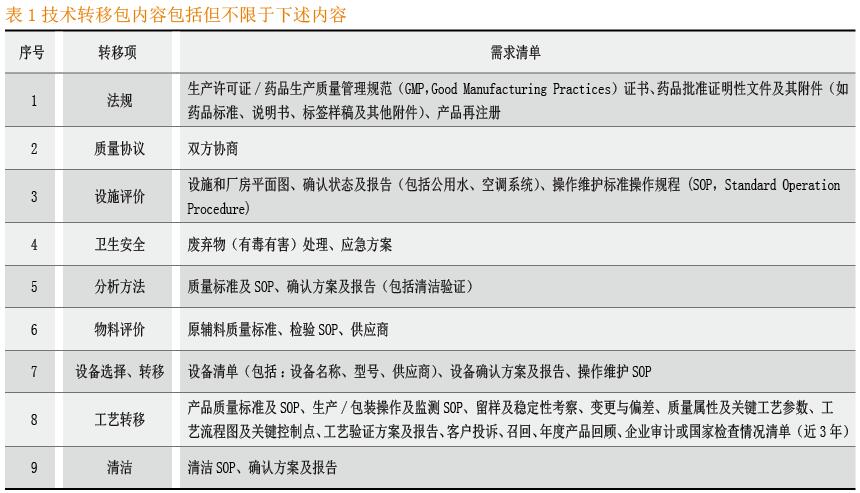
所有运行工艺以及分析产品所需要知识的采集。技术转移包应经过转移双方确认,确认所需的信息是全面的,以便接收方可以有效运行分析规程或工艺。必要时,主题专家应参与技术转移包审核,以确保获得必须的转移知识。技术转移包内容包括但不限于下述内容,见表1[3]-[4]。
技术转移风险评估及转移计划
1、风险评估-转移双方依据技术转移包相关信息从“人、机、料、法、环、测”六方面结合法规要求来进行风险识别、风险分析、风险评估及风险控制以确定风险优先性[5]。
人员:根据转出方产品特性、法规要求及对工作经验及能力的要求,对企业检验人员、质量保证部人员、生产操作人员和设备操作维护人员进行对比分析;对产品生产过程中使用及生产中产生物料,依据物料特性及对人员可能产生的危害等,与企业目前实施的安全措施进行对比确认。
厂房设施:与转出方生产布局图(包括人、物流图)对比分析,对生产工序进行确认是否满足生产要求,其次是环保、安全方面的要求(如生产过程产生物料、废弃物)进行比较确认;根据研发数据以及预期用途将企业现有设备与转出方研发/生产设备的原理、能力及生产工序对设备要求进行比较确认;根据检验标准要求对转出方提供的物料、产品检验仪器明细(型号、精确度等)与目前检验仪器进行对比确认;根据标准及检测要求对转出方公用系统设计要求、能力等与企业目前使用或新增的公用系统进行比较确认。
环境:与转出方提供的空调系统(HVAC) (HVAC,Heating, ventilation and air-conditioning systems)在压差、温湿度、洁净级别及交叉污染要求等与企业现有HVAC系统来进行对比分析。
物料:与转出方提供的产品所对应的原辅料、包装材料的质量标准(包括物料特性、级别)和生产商等以及生产过程中产生物料的特性要求来进行对比分析。
检测:与转出方提供的原辅料、包装材料、成品、中间产品控制项目的检验方法(包括清洁验证检验方法)进行对比确认,评估目前使用检验方法的适应性。
生产操作:与转出方提供的生产操作及工艺流程要求对比评估技术转移后的生产流程、生产工艺步骤的适用性。
2、技术转移计划-转移双方依据风险评估优先性结果,对高中风险制定详细计划,明确需要采取的降低风险的措施,对于低风险应在计划明确并结合剂型特性可能不需要采取措施。转移计划应经过转移双方负责人审核、批准。在采取措施风险降低后,残留风险应在技术转移计划中明确,并传达给接收方管理层。
应基于质量风险管理,对转移项目的质量方面给予指导。
转移计划中应包括在差距分析/风险评估及交付期望中所辨识的任何风险降低措施。
技术转移实施
技术转移双方依据技术转移计划中制定的措施、时限来组织人员进行实施,以确保转移顺利进行。
1、培训:转出方和接收方应共同实施所有可能需要与即将转移的产品、工艺或方法相关的培训。如分析方法或设备操作培训等,并对培训效果进行评估。
2、分析方法:在测试方法转移之前,转出方应当确证检测方法符合上市许可或相关技术文件的规定。接收方应当审核测试方法原始验证资料,并实施差距分析/风险评估,以便在开始技术转移过程之前,确定应该实施的任何补充验证。
用于检测药品、起始物料、包装材料和清洁残留样品的检验方法,均应事先在化验室进行试验,然后才可用于检测接收方工艺验证中的样品。
制定分析方法转移方案,说明转移的步骤及标准。分析方法转移方案应包括目的、范围、接收方和转出方责任、原料质量标准、检验方法、试验设计和可接受标准、文件记录、处理偏差的程序、对照样品的详细信息。
分析设备要求、分析参考标准品/试剂/柱/培养基等详细说明及与分析操作相关的环境、健康、安全要求。
3、清洁验证:在生产过程中,制剂和原料药可能会受到其它制剂或原料药的污染。为最大程度减少污染和交叉污染及对操作者和环境的影响,需要建立充分的清洁程序,对并清洁程序的适用性进行验证。转出方应提供必要信息以便于接收方制定清洁验证策略,提供的信息包括但不限于,见表2 [3]。
4、验证确认(包括工艺与设备等):接收方应根据接收信息及转移计划起草验证/确认主计划,起草确认/验证方案明确设备设施确认要求、接受标准及产品工艺验证参数、验证批次及接受标准等。
在实施产品/设备确认前,应确保所需分析方法已完成转移并达到满意结果及法规要求。
转出方指导接收方完成样品试制、规模放大和生产工艺参数验证的实施以及批生产等各项工作,并试制出质量合格的连续3个生产批号的样品。且接收方生产的药品应当与转出方生产的药品质量一致。
接收方生产规模的变化超出转出方原规模的十倍或小于原规模的十分之一的,应当重新对生产工艺相关参数进行验证,并提交验证资料。
接收方对生产3批样品进行3~6个月加速试验及长期留样稳定性考察,并与转出方药品稳定性情况进行比较。
5、转移双方需要依据剂型特性进一步细化上述操作来降低或减缓风险,以确保产品质量有效、安全并符合注册要求,且分析程序准确、有可操作性。
技术转移完成与审核
转移双方根据转移前制定的转移计划、转移成功标准及风险除低措施的实施情况来确认。接收方可通过已经确认的工艺来生产产品,并通过对所生产产品分析,证明关键质量属性已经维持,技术转移可认为是成功的;其次是审核可能需要辨识补救计划。
通过中间工艺数据与历史数据来进行工艺性能比较,符合要求;符合预先设立的产品质量
标准;控制措施可有效实施;符合药监部门要求;达到健康、安全及环境目标。
技术转移报告
将技术转移项目程序、可接受标准、达到的结果和结论进行汇总的文件。所有偏差均应有讨论和判定,包括必要的纠正措施。
技术转移报告应经过转移双方负责人审核批准。
接收方应执行工艺监测并对任何异常工艺趋势与转出方进行沟通评价。
必要时,转移双方之间应实施定期生产沟通会议来排查工艺问题,转出方提供必需的技术支持。

技术转移关闭
在技术转移完成后,转移双方应对剩余风险进行最终的评估管理,并作为技术转移关闭的一部分进行记录。技术转移小组应进行审核,已记录并同意已经解决所有关键问题,接收方已对任何尚未完成的项目进行签字。成功的技术转移应确保所有的高中风险已得到解决,及所需要采取的措施获得接收方同意,并应当记录残留风险是可以接受及获得接收方同意的理由。
结语
本文从技术转移过程的七个方面来描述用于技术转移的一般惯例,并对转移过程进行浅析和解读。转移双方需要依据转移实施阶段并结合转移双方资源、实力以及法规要求来确认需要从几个方面来实施转移,以确保产品质量有效、安全并符合注册要求或分析程序准确且具有可操作性。其次是为目前正在实施或即将实施技术转移的企业提供必要的借鉴和参考。
【参考文献】
[1]实施新修订药品生产质量管理规范过程中药品技术转让有关事项的通知,国食药监注[2013]38号[S];
[2] ISPE Good Practice Guide-Technology Transfer国际制药工程协会(ISPE,International Society For Pharmaceutical Engineering)质量管理规范指南第二版技术转移,2014 [S];
[3]WHO Technical Report Series, No. 961, 2011 WHO第961号技术报告,附件7药物生产技术转移指南(World Health Organization 世界卫生组织) [S];
[4] 关于印发药品技术转让注册管理规定的通知,国食药监注[2009]518号[S];
[5]PDA Technical Report No. 65-Technology Transfer注射剂协会(PDA,Parenteral Drug Association)技术报告65号技术转移,2014 [S]。
本文系奥星制药设备(石家庄)有限公司职员。







加载更多