智能生物医药品制造系统
生物产业是 21世纪创新最为活跃、影响最为深远的新兴产业,是我国战略性新兴产业的主攻方向,对于我国抢占新一轮科技革命和产业革命制高点,加快壮大新产业、发展新经济、培育新动能,建设“健康中国”具有重要意义。“十二五”以来,随着现代生命科学快速发展,生物经济正加速成为继信息经济后新的经济形态,对人类生产生活产生深远影响。靶向药物、细胞治疗、基因检测、健康大数据等新技术加速普及应用,智慧医疗、精准医疗正在改变着传统的疾病预防、检测、治疗模式,为提高人民群众健康质量提供了新的手段。
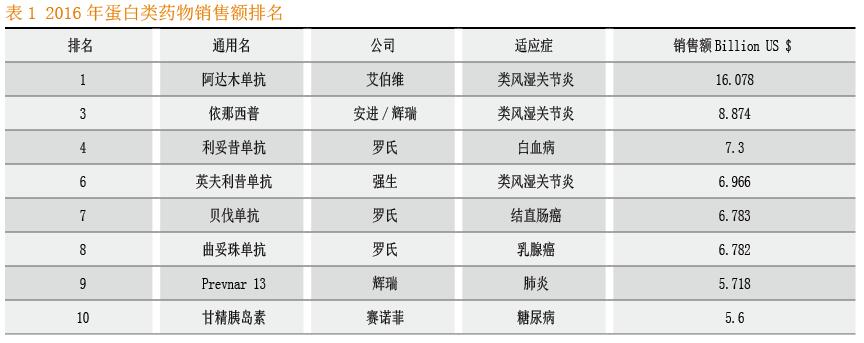
蛋白类药物作为靶向药物和精准医疗的典型,在2016年全球药物销售额排名前十中占据8席,其中5种是单克隆抗体。
国内抗体的发展步伐紧跟国际先进水准,企业以提升药物品质为目标,不断提升制药过程的自动化、数字化和智能化水平。中试到规模化生产的自动化控制从企业的角度来讲,有利于提高生产效率以及产品质量,更深层次的意义是对国家十三五发展规划的积极响应,促进单克隆抗体、长效重组蛋白、第三代胰岛素等高技术含量生物仿制药的发展,提高我国患者的药物可及性。
抗体的工艺控制过程通常包括:配液系统、生物反应器培养系统、分离收获系统、过滤系统、层析系统、超滤系统等,各个系统的成套设备相对独立,控制较为分散,无法做到数据的统一高效管理。比如分离收获系统和层析系统,需要有两套用户权限管理文件,两套系统安全性管理文件,两套数据备份恢复管理文件,如果生产线是多条的话,Q(qualification)的工作量极大,明显增加了企业工程实施难度和周期。对于单抗研发生产工艺过程中,如果不同系统间无法实现数据交互,也就无法直观方便地为scale-up和scale-down提供强有力的数据支持。
特别是在国家食品药品监督管理总局CFDA发布了《计算机化系统》和《确认与验证》两个附录,作为《药品生产质量管理规范(2010年修订)》配套文件 (2015年12月1日起施行),国内企业对数据可靠性慢慢开始重视,这就促使我们思考一个问题,如何在生物医药生产线流程全局自控的层面,既满足药品生产过程的工艺控制要求,又能够实现高效、有效、安全、符合法规要求的数据管理?
安曼科技开发出的Bio-PAS,既满足抗体研发生产工艺对全流程数据的需求,又实现法规对数据可靠性的要求。Bio-PAS是根据生物制药工艺特点,基于先进控制系统深度开发而成的智能生物医药品制造系统,辅以精密高效的执行单元,涵盖生物制药上下游制造全过程控制。该系统强大的通讯集成功能,实现数据的集中采集、显示和处理,解决了工艺开发及规模化生产过程中成套设备数据分散的问题,更为重要的是,解决了集中式的用户权限管理,审计追踪管理等问题,这是即使上了SCADA也是无法比拟的优势。
对于高端生物医药企业来说,时间成本和合规性成本对能否取得战略高地具有现实的意义。Bio-PAS在全局自动化控制的层面,基于ALCOA+CCEA的基本要求指导来确保数据可靠性,同时符合21 CFR PART 11要求,基于GAMP5实施完整、合规的生物医药全局工艺自控计算机化系统验证,缩短了生产线系统的验证周期,同时在系统运行阶段能更有效地管理,降低合规风险。三生国健(原中信国健)作为中国领先的生物制药企业,其拥有中国规模最大的单克隆抗体生产线,以及国内CRO领军企业药明康德,在生物制药智能制造方面都采用了类似的模式,有效的推动了工程实施,促进后期的运营管理,并通过FDA和客户的审计,获得了高度的认可。
从需求理解、配置开发、适配工艺、数据整合、模块控制等方面考虑,我们的解决方案助力生物医药智能工厂建设,推动生物智造的规模化应用,为生物医药的创新和产业化,为国家的两化融合贡献着我们的力量。
林煌
本文作者系南京安曼科技有限公司质量合规主管。







加载更多