制药行业的分布验证和监测
制药业需严格遵守强制性的国际规章——为了证明产品的质量,任何药品必须满足的最低要求就是美国FDA等监管机构制定的规定。不受控制的温度和湿度可能导致在生产和储存期间对原料和最终产品造成巨大的损害。
湿度和温度分布验证
湿度和温度分布验证是通常在生产和存储区域中进行的过程,以确定所有可能的湿度和温度梯度。为了获得精确的房间分布映射,需要策略性地放置数据记录器以便找到热点和冷点并且在一定时间段内监视不同的参数。还必须考虑诸如阳光直射,暖气,空调和窗户的因素。

对测量数据分析后,可以定义产品的最佳存储位置或优化室内气候。例如,可以通过改善热隔离或改变空调系统的工作方式,从而使室温更加均匀。基于该数据,制药公司就能够将传感器和测量装置放置在适当的位置并将它们连接到符合规定的监控系统。
制药行业的监测
不受控制的温度和湿度可能导致在生产和储存期间对原料和最终产品造成巨大的损害。在这方面,制药业需严格遵守强制性的国际规章。为了证明产品的质量,任何药品必须满足的最低要求就是美国FDA等监管机构制定的规定。这些监管要求也适用于数据记录系统和软件。为了在制药工业中应用,这些设备要符合良好自动化生产实践(GAMP)和FDA CFR Part 11,即“适用于根据机构规章规定的任何记录要求进行创建、修改、维护、存档、检索、传输的电子表单的记录”。为了验证流程和设备,需要提供书面证据,表明该系统安全和重现性好。该系统必须在实际使用过程中满足先前规定的要求,并且在引入该系统后以合规的方式运行。


Rotronic提供的解决方案
房间分布验证
HygroLog HL-1D是一款紧凑、低成本且拥有±3.0%RH和±0.3 ℃精度的数据记录器。内部存储器最多可存储16 000个数据点,包含HW4-Lite软件。HW4-P和记录器都符合FDA 21 CFR Part 11 / GAMP 4标准。
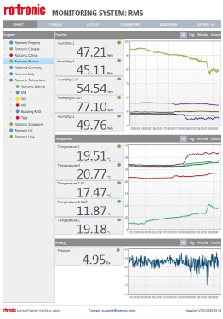
环境监测系统
现在我们了解了为什么需要对某些区域进行热映射,除了记录器,Rotronic还提供符合FDA标准的监控系统。Rotronic监测系统(RMS)允许用户对应用环境进行全球范围的监测(涵盖所有的冷点和热点)。 RMS能够实现实时监控,当任何测量点达到临界状态时会发出报警,并能够及时通知到相关负责人员。
事实&数据
FDA负责管理规范食品,药物,疫苗,血液制品,医疗器械,电子产品,化妆品,兽医产品和烟草制品。2014年全球医药支出第一次超过了10 000亿美元。请想一下,10 000亿美元相当于全球GDP的1.3%,高于全世界中15个国家的年度GDP。在20世纪70年代中期,为了提高药品质量,两个FDA官员Ted Byers和Bud Loftus率先提出“验证”概念。它针对大剂量注射用药市场的若干无菌消毒问题提出了应对措施。
主要特点
● 符合GMP / GLP / GDP
● FDA 21 CFR Part 11
● EN 12830
● PDF 图表和统计报告
● 通过语音电话,短信或电子邮件报警通知
● 服务器或基于云的软件
● 适用于智能手机和平板电脑
验证
当系统得到请求时,系统会通过自检自动检查数据完整性,它将所有输入模块切换到各种状态,检查要触发的报警,并在整个系统上生成验证报告。
本文由瑞士罗卓尼克公司提供。







加载更多