洁净室:从概念到确认系统的路径

关于采购的良好工程规范(GEP)
从用户需求说明(URS)的定义开始,规划阶段 被细分为四个阶段:
-
前期规划 -
概念规划 -
精细规划 -
实施的规划
执行阶段包含三个阶段:
-
实施/施工 -
调试、培训 -
确认
本计划是基于既定的良好工程规范(GEP)原则。应当注意,各家制药监管机构也推荐把GEP作为制药工厂设计的方法论。
GEP在药品生产设施的概念、规划和施工中的关键要素总结如下:
对当地施工法律和其他相关法规的遵守
制药法规的知晓
相关法规和制药指南的知晓
按照当前最先进科技水平奉行洁净室技术 1
根据生产工艺的要求与用户一起制定并评估或权衡所有要求
对工艺流、物流和人流的考虑,目的是为了消除或至少尽可能减少污染风险
在挑选配件的时候运用价值分析和风险评估。
所有这些要求都是逐步并且迭代实施的,并且被包含在URS中。它们形成进一步确认步骤的基础,而进一步确认则是作为药物用途的先决条件。欧盟GMP指南的附录15除了其他内容之外也描述了关于工厂和设备的要求。
实际上,已经证明提供一份房间手册作为洁净室施工的URS的附录并将其用于核对FDS(功能设计说明书)是成功的做法。在确认的背景下,它还能作为对各个确认步骤进行核验的一份参考文件。
由供应商提供的功能设计说明书(FDS)规定了URS将会怎样实施。然后检查FDS的合理性以及URS中所列全部各项要求是否被完成并被调整(如果需要)或被否绝。
“URS”和“FDS”的用词对于洁净室施工和公用工程(电气、通风、空调、压缩空气等)较不常见。设计者通常会制定一份说明清单,上面有基于URS说明的功能描述、数量和公用设施。这份性能说明清单被视作为等同于FDS,因此不需要“转化”成一份新的文件。
图3.E-3从概念到确认系统的路径
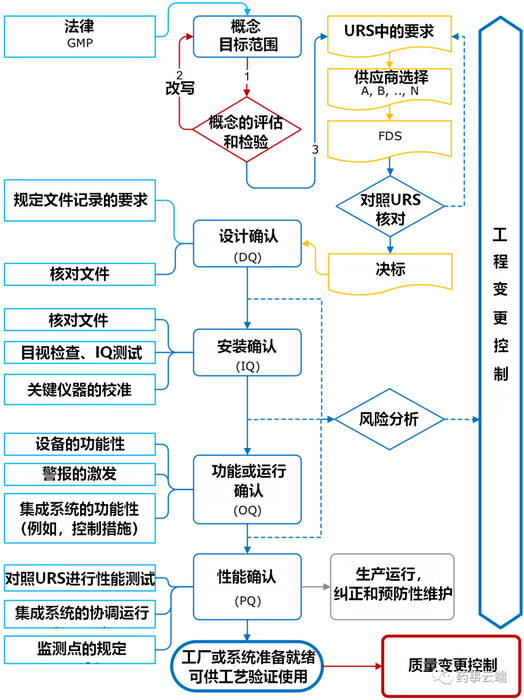
1各项标准和其他指南都仅仅被视作为建议,并不一直代表当前最先进发展水平。
热点文章
-
一文搞定制药设备清洁验证分析方法的开发与验证
2024-03-12
-
偏差流程要点分析和偏差处理成熟度的考量
2024-02-29
-
工艺验证“连续三批”的含义?
2024-02-29
-
【汇总】药品GMP现场检查常见问题
2024-02-13
-
中药口服固体制剂制造分类系统: 工艺路线分类
2024-02-05
-
关于 B 证药品上市许可持有人供应商审计的思考
2024-03-01
-
共线生产风险评估及清洁验证考虑要点
2024-02-04
-
基于微生物的控制对制药纯化水存储分配系统的优化设计
水非常容易滋生微生物,微生物是制药纯化水质量标准中关键的质量属性。微生物比电导率和总有机碳更难控制。因此,需要分析研究现有制药纯化水系统控制微生物的不足,从而对系统进行优化改进。本文分析了制药纯化水存储分配系统在控制微生物上存在的问题并提出了改进方案。
作者:叶勋
-
即将开幕,报名从速|2024PHT·固体制剂高质量发展论坛盛邀您的参与!
-
计算机系统在制药行业追溯体系应用中存在的问题与解决措施
-
非最终灭菌无菌制剂的污染控制策略
-
创新赋能行业,聚力共赢未来
-
论计算机化系统和数据完整性









评论
加载更多