持续工艺确认执行策略及实施应用
1 引言
1.1 2010 版《药品生产质量管理规范》(GMP)附录《确认与验证》第27 条:持续工艺确认(CPV):在产品生命周期中,应当进行持续工艺确认,对商业化生产的产品的质量进行监控和趋势分析,以确保工艺和产品质量始终处于受控状态[1]。
1.2 美国注射剂协会(PDA)第60 号技术报告《工艺验证:生命周期方法》[2]中提到生命周期的三个阶段见图1。
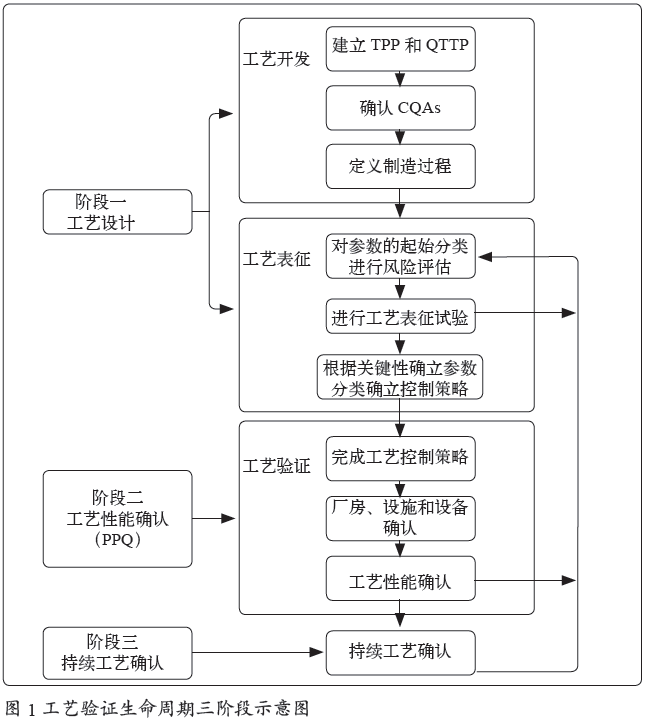
1.3 持续工艺确认目的:确保工艺成功验证后,在日常商业生产过程中,保持工艺的验证(受控)状态。
不是所有的变化来源,都能在阶段1(工艺设计)和阶段2(工艺性能确认)中预计和确定。持续工艺的监控能帮助发现不可预期的事件或趋势,提示可能的工艺控制问题和/ 或工艺改进的机会。
2 逻辑原理
原理1(逻辑基础):工艺过程的稳定、受控包含输入稳定和输出稳定两方面。输入稳定是输出稳定的前提,只有输入与输出均稳定,才能证明整个过程是稳定的。输入包括变量“可控因子”与 “非可控因子”,输出为“响应变量(CQA)”及其他异常输出。逻辑原理见图2。
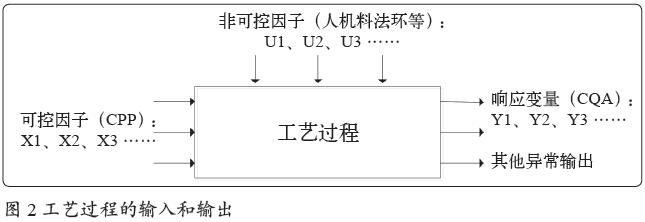
原理2 :可增减的评估策略,评估工艺需考虑多方面因子,当认为参考不足够时,则需考虑增加更多的因子。
原理3 :评估的前提是建立标准,通过与标准对比来证明没有明显变坏的趋势(或对比前后两个阶段来证明稳定)。此处注意:当发现有任何输入因子变化时,可认为是具有潜在导致输出CQA不稳定的可能。
3 持续工艺确认主要涉及内容
3 . 1 工艺输出: 响应变量(CQA)关键质量属性(CQA):指某种物理、化学、生物学或微生物学的性质,应当有适当限度、范围或分布,以保证预期的产品质量。(GMP 附录《确认与验证 》第54 条)
成熟工艺的CQA 来源:
● 药品属性:安全、有效、均一、稳定。
● 质量标准:注册标准/ 国家药品标准/ 药典中的项目。
通常质量标准上指标即为成品的关键质量属性,只有符合所有质量标准项才能保证药品的安全、有效。
应用:工序影响CQA 评估实例见图3。
评估时,需对相关工序如何影响CQA 进行说明(建立联系)。
评估后:对于高影响的CQA,针对参数项目,如水分、崩解、装量差异、含量等,进行评估分析(趋势图/ 控制图/ 能力分析);而对于性状、鉴别、产品稳定性只描述其情况,如性状,2019 年1 ~ 2 月,15 批均合格。对于含量均一性只需检查其是否有相应均匀性的验证即可。
3.2 工艺输出:其他异常输出有关工艺输出的其他异常输出信息可参考表1内容。

3 . 3 工艺输入: 可控因子(CPP)
可在生产中加以调节控制的因子是输入变量,影响着过程最终结果。
关键工艺参数(CPP,同义词:关键操作参数):工艺参数的变化对关键质量属性会有影响,因此应当监控和控制工艺参数,确保加工的产品达到想要的质量。
重要工艺参数(KPP,同义词:重要操作参数):输入工艺参数应当在很窄的范围内加以仔细控制,其对加工性能是必不可少的。重要工艺参数不影响产品质量属性,如果超出可接受的范围,它将影响工艺(如产率、持续时间),但不影响产品质量。此处注意:因涉及产量等经济指标,大部分公司KPP也按CPP进行管理、验证。
非重要工艺参数(Non-KPP,同义词:非重要操作参数):输入参数已被证明易操作、控制或者有着很宽泛的接受限度。如果超出可接受限度,非关键性操作参数可能会对质量或工艺性能产生影响。参数关键性决策见图4。
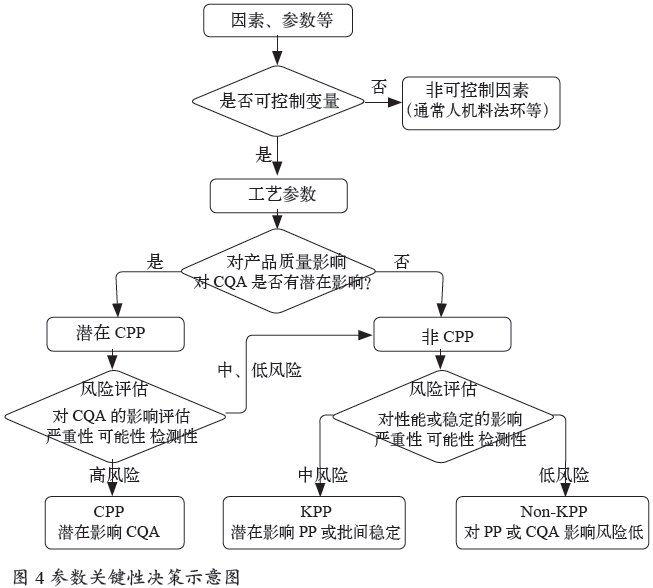
确定为CPP的参数,就是工艺验证时检查的参数。
对于范围参数,还需有对应的验证,如充填速度“2800 ~ 3300转/min”, 在设备PQ 进行不同充填速度(2800、2900、3000、3100、3200、3300)设置的性能检查,指标为充填装量差异、外观、上机率等,以考察速度对质量和性能指标的影响,并确定其稳定可靠的范围。
持续工艺确认时记录CPP参数及实施批次,如充填,2019 年1 ~ 2 月,15 批充填速度均为3100 转/min)。若有不同设置时需注明。
此处注意:考虑到“重要工艺参数(KPP)”影响收率、时间等经济指标,对于公司而言是重要的,也可按CPP 进行管理。
3.4 工艺输入:非可控因子(人机料法环等)
非可控因子[3]:影响过程及结果的变量除了可控因子外,还可能包含一些可以记录但不可控制的非可控因子(图2中的U1、U2、U3……),它们通常包括环境状况、操作员、材料批次等。这些变量可能取连续值,也可能取离散值。对于这些变量,通常很难将它们控制在某个精确值上,实际问题中它们确实也可能取不同的值。
持续工艺确认时,相应情况描述对比分析即可。评估应用举例如下:
生产过程中各部门的作用和职责(组织机构有无变化):2019年1 ~ 2 月现行组织机构文件SMP-RG-0001-04,该文件自2017年6 月16 日生效至今,经核对实际组织机构没有变化。(注:若有变化则提供变更前后的组织机构图,并评价可能的影响。)
人员变化对工艺的影响,应用案例见表2。

结论:人员有个别变化,可能存在潜在影响。但从工序特点来说,人员的影响主要为操作失误可能造成的收率波动,故可由总混收率是否异常波动、趋势异常判断。若操作分班组,则可能存在班组间的变化。
3.5 持续工艺确认执行策略[4]
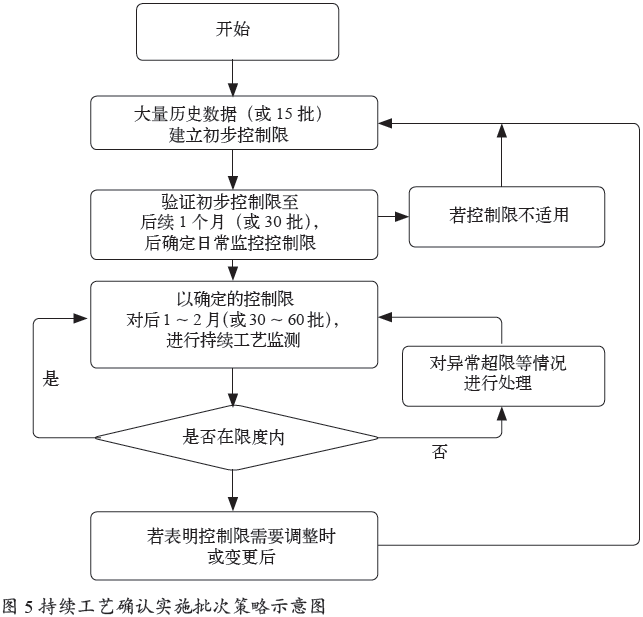
3.5.1 实施批次策略(见图5)
3.5.2 评价指标CQA 的限度制定方法
方法1 :期望的工艺指标本身性质应该是正态的,并且监测数据符合正态时。以数据均值±3σ作为控制限,数据不正态时计算的限度存疑(不正态时标准差的统计计算公式不成立)。若数据量少,所得限度将可能不涵盖所有范围,造成控制限适用性不好。
方法2 :适合数据非正态,以大量数据(大量历史数据:至少100 批,最好超过300 批),用百分位数法得出限度。如用相同工艺条件下连续几年的数据为计算限度,此处注意要结合经验判断限度是否合适。举例来说:2.5%分位数作为下控制限,97.5% 分位数作为上控制限。(2.5% ~ 97.5%数据范围可以理解为4 倍标准差的水平,因为±2σ 包含95.45%的数据。)注:其他任何有文献依据的方法均可尝试使用。
3.5.3 CQA 趋势评估应用
实例1 :评价总混工序的工艺趋势,评价指标CQA 总混含量。
建立限度:2017 年和2018 年所有生产批次,共341 批数据;以2.5% 分位数3.6 作为下控制限,97.5% 分位数4.3 作为上控制限。(注:法定标准≥ 3.2)
评估应用:2019 年1 ~ 2 月,共15 批(均值为3.82)数据,并在时间序列图上添加Y 值参考线:下限3.6 ;上限4.3 ;均值3.82,见图6。
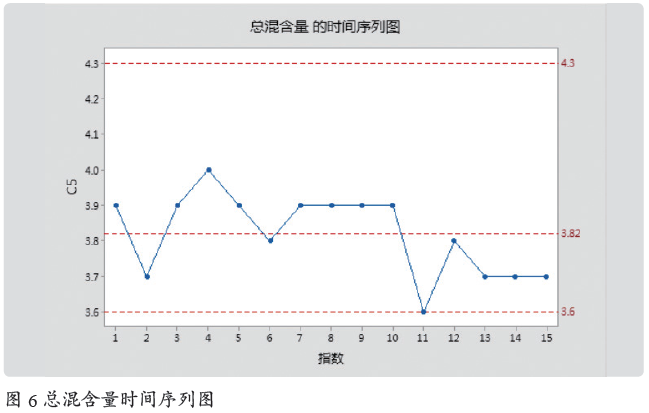
分析:观察进行检验分析:①超限:没有;②连续7 点在中心线一侧:没有;③连续7 点全部递增或全部递减:没有;④连续14 点,上下交错:没有。结论:总混工序总混含量稳定,工艺稳定。
实例2:充填工序的工艺趋势,评价指标CQA 充填装量。
2019 年1 ~ 2 月,共15 批数据(每批10 个数据),首先进行“图形化汇总”,P 值=0.122,通过了正态检验,即可以进行能力分析。进行“Capability Sixpack”(六合图)正态的能力分析,数据每批10 个,子组大小为“批号”,下限为0.322,上限为0.378。输出六合图见图7。
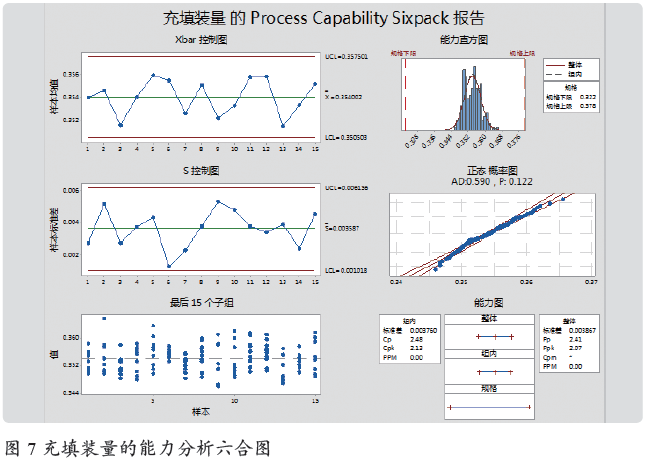
分析:左上Xbar 图:没有任何超限点,均值稳定;左中S图:标准差均在限度范围内;左下最后15 个子组:上下交错单个值没有超限点;右上直方图:没有孤岛值;右中正态概率图P 值> 0.05 符合正态;右下能力图:CP=2.48、CPK=2.13, 均> 2,能力特优,并且CP 与CPK 接近,表明没有异因的存在。结论:充填工序装量控制能力特优,说明人员和设备性能均非常好,操作规程非常合适。
注意:运用时一定要注意检测指标的性质,这决定了指标的分布类型,对于统计分析很重要。
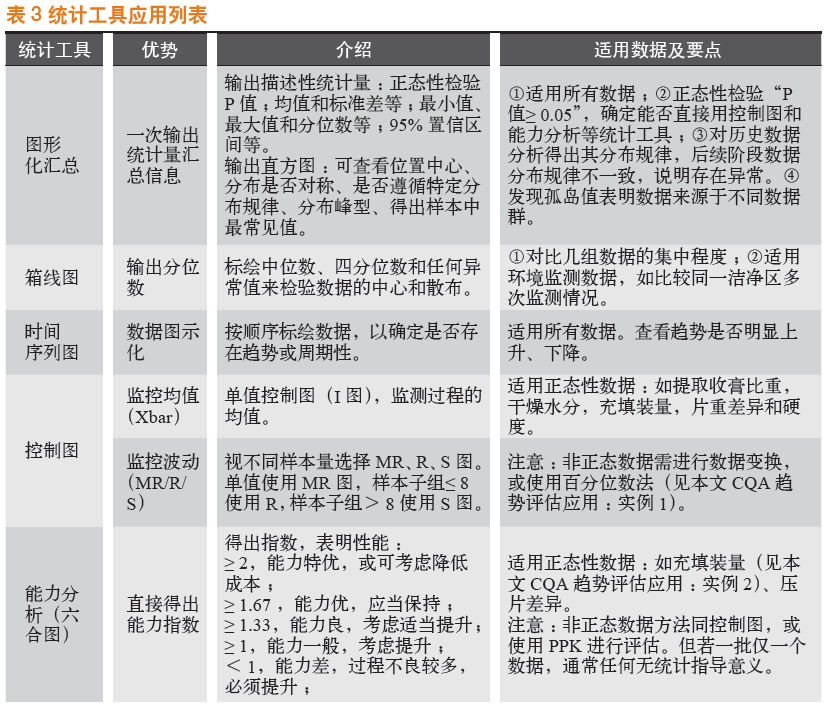
3.6 常用统计工具针对制药企业数据,常用的统计工具见表3。
3.7 工艺验证、持续工艺确认、年度回顾的对比在实施过程中,常常会发生工艺验证、持续工艺确认[5]、年度回顾概念相混淆的情况,下面将从几方面进行比较,以帮助区分和理解,详见表4。

4 讨论与结论
经实践得出持续工艺确认可简单归纳如下:
● 确定目标:CQA和CPP;
● 确定工艺输入稳定:生产时人机料法环状态稳定;按照CPP执行生产;
● 确定工艺输出稳定:按计划进行取样, 收集检验结果CQA 数据, 并进行统计分析,得出质量趋势;收集阶段性的投诉、偏差等“异常报告”的数量及情况;
● 综合输入和输出评估工艺是否稳定,或建立“基准状态”(即后续确认情况与基准对比,从而得出是否稳定)。
但有两点值得注意:
● 确定CQA、CPP 是最先、最基础的工作。需要投入大量专业人员参与,特别是研发人员和生产人员,研发掌握着工艺设计时基础研究资料,生产和质量掌握着实际生产效果,三者的结合才是理论和实践的结合。
● 真实、及时收集数据是持续工艺确认的执行关键。只有真实的数据,才能反映真正工艺情况,假的数据只能得到错误的结论,且无法指导改进;一切假的、被美化过的数据都是在浪费人力、物力。
【参考文献】
[1] 国家食品药品监督管理局:2010 版《药品生产质量管理规范》(GMP)、附录《确认与验证》.
[2]PDA TR60 Process Validation:A Lifecycle Approach 美国注射剂协会(PDA) 第60 号技术报告《工艺验证:生命周期方法》.
[3] 马逢时, 周暐, 刘传冰. 六西格玛管理统计指南-MINITAB 使用指导. 中国人民大学出版社.
[4] 王亚涛, 赵九洲, 靳杰, 李香梅. 新版GMP 附录中“持续工艺确认”方法探析[J].机电信息,2016(05):12-14+58.
[5] 贾晓艳, 祁飞. 浅析工艺验证中的持续工艺确认执行策略[J]. 机电信息,2016(32):12-14.







加载更多