Biacore分子互作技术加速抗体药研发和申报
抗体药具有性能均一、特异性好的优势,在肿瘤、免疫等各类疾病的治疗中发挥着重要作用。国家药品监督管理局(NMPA)颁布了多个抗体药物法规及指导原则,规范抗体药物的研发生产及申报流程。随着原研药在国内的上市和药品采购价格的下滑,加快研发效率、降低生产成本成为抗体药市场竞争的关键。抗体药研发涉及筛选、活性检测、表位作图、一致性评价、免疫原性和质量控制等环节。Biacore 作为药物活性检测平台,可以满足药物研发多个环节的需求,加快研发速度,其准确稳定的数据质量已经得到了药企和监管部门的广泛应用和认可。目前,Biacore 基于表面等离子共振技术已经被中国、美国和日本药典收录。本文将利用抗体研发与质控中的几个重要环节来展示Biacore分子互作技术的原理和应用。
抗体筛选与定量
细胞株的好坏很大程度上决定了抗体药的质量和成本,因此细胞株的筛选与定量是抗体药研发的关键环节。ELISA 法由于检测精度差、自动化程度低等问题,已经无法满足细胞株筛选的要求。Biacore 技术可以大大提高抗体筛选的效率和准确性,实现上清、腹水的直接检测。动力学数据在抗体筛选中尤为关键,因为解离速率决定了抗体的在靶时间,解离速率慢的抗体成药性更好。Biacore 技术通过检测解离速率的快慢完成排序,抓取出想要的候选分子。表达量也是细胞株开发的重要指标,在采用Biacore技术进行动力学筛选时,同时还可以基于捕获量的高低对抗体浓度进行定量,将浓度定量与筛选实验合二为一,大大简化了筛选流程。例如,罗氏(Roche)就采用了Biacore 技术进行抗体筛选,在24 h 内完成了近400 个抗体的检测,并筛选出了慢解离的候选抗体,进行进一步开发。
药物结合活性综合表征
在抗体体外生物活性检测项目中,抗体与抗原、Fcγ 受体、FcRn 以及C1q 的亲和检测均需采用Biacore 技术进行申报。目前美国食品药品监督管理局(FDA)批准上市的70 多种抗体药物中有近80% 采用了Biacore 技术完成研发和申报。例如,礼来的Taltz在2016 年获得FDA 批准用于治疗银屑病。Taltz 对IL-17A 具有较高的亲和力和特异性,可以抑制IL-17A 与IL-17 受体的结合。在申报材料中,Biacore 技术用于检测Taltz 与靶点IL-17A 的亲和力(图1)。

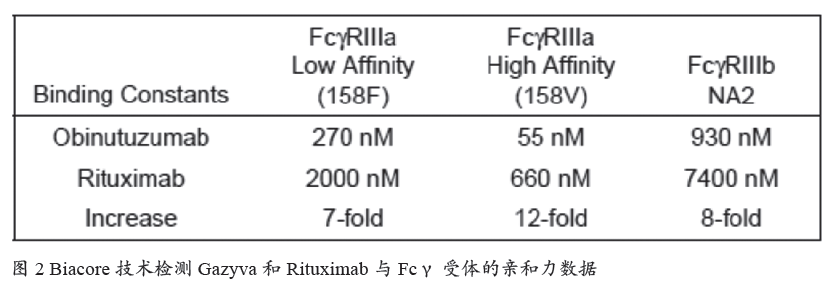
治疗性抗体的功效不仅取决于Fab 片段结合抗原的活性,还取决于其Fc 片段与Fcγ 受体的相互作用,Fcγ 受体的亲和力能够作为药物功效及半衰期的预测指标。2013 年,Roche 针对CD20 靶点的单抗Gazyva 获批上市,用于慢性淋巴性白血病的治疗。在申报材料中,Biacore 技术用于Fcγ 受体结合活性的测定,结果显示Gazyva 比美罗华有更好的FcγRIII 结合能力(图2)。
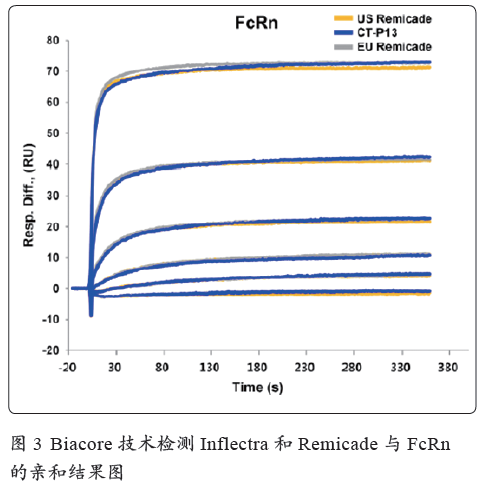
抗体与FcRn 的亲和强弱程度可以预测抗体的半衰期。Celltrion 公司的Inflectra 是Remicade 的生物仿制药。在申报材料中,Biacore 技术用于证明Inflectra 和Remicade 与FcRn 结合的一致性(图3)。
C1q 是补体激活途径中的启动蛋白,C1q 的常规检测方法为ELISA,但由于抗体和C1q 的结合较弱,采用ELISA 法检测可能出现假阴性结果。因此很多企业选择采用Biacore 技术检测抗体和C1q 的结合,如罗氏的抗体药Ocrevus。
一致性评价
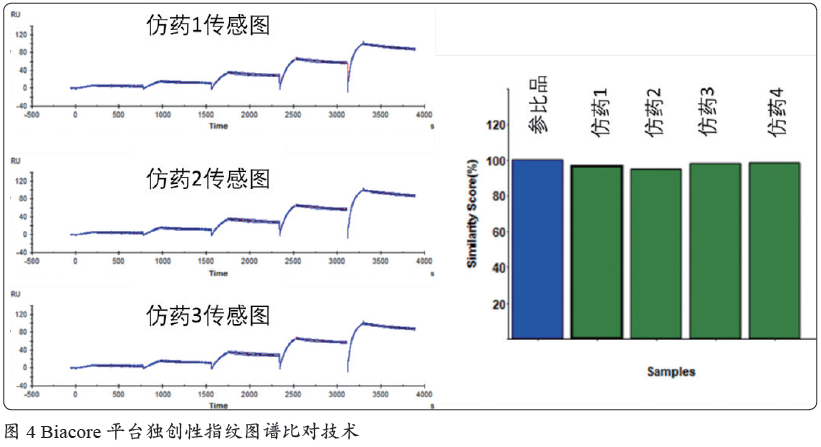
2016 年起, 国务院和国家食品药品监督管理总局(CFDA)发布了多个一致性评价的指导文件,对通过一致性评价的品种给予优先支持、医保支付等优待。一致性评价中关键一环是说明药物的生物活性和原研药的相似性。在FDA 生物类似药指南中,Biacore 技术是结合测定的首推方法。众多企业在一致性评价中纷纷采用Biacore 技术进行了申报上市,如Zarxio、Inflectra 以及Benepali 等。Biacore 独创性地开发了指纹图谱比对功能,利用其可以直接进行传感图细节比对并作出相似性打分,避免了由于拟合模型选择等操作带来的分析误差,使结果更加直观和准确(图4)。
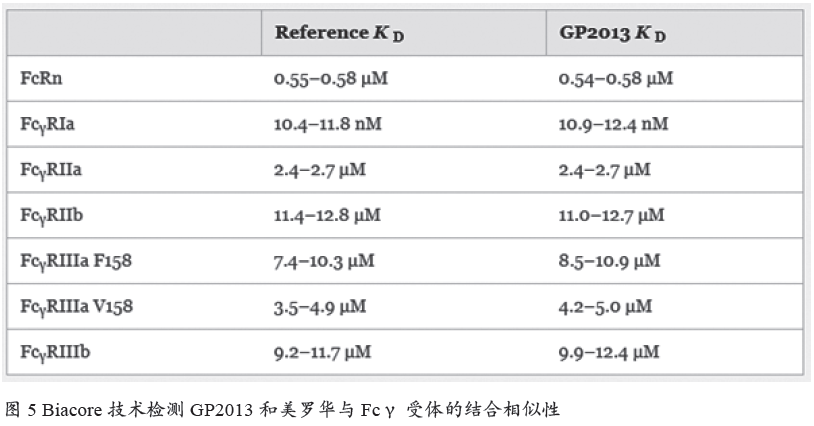
Sandoz 公司的GP2013 是美罗华的生物类似药。在GP2013 的申报材料中,Biacore 技术被用于Fcγ 受体的亲和力测定,用来说明GP2013 与原研药的高度相似性(图5)。
生物活性质量控制
抗体药物由于分子量大,结构复杂,生物活性敏感,其工艺中每个环节的变化都可能导致产品质量出现差异。因此企业应对抗体药物工艺流程中的关键质量属性( 特别是生物活性) 进行实时监测、控制和放行。基于Biacore 平台可以建立全面的质控标准,完成结合活性、活性浓度、翻译后修饰和杂质含量等的质量控制。Biacore 平台可以实时监控各工艺流程组分中抗体的生物活性,如细胞培养、过滤、澄清等;活性有问题的抗体会出现解离加快、结合信号降低的现象,以帮助企业快速发现工艺中的问题。
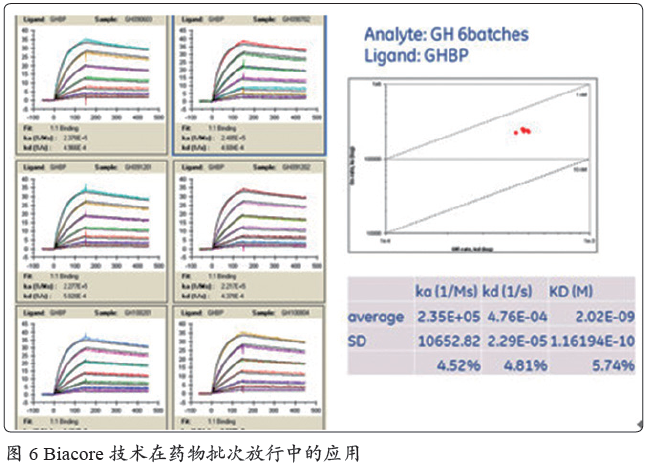
Biacore 技术还可以用于最终产品的批次放行, 例如金赛药业基于Biacore 技术的生长激素蛋白批次放行标准获得了中国食品药品检定研究院审批通过(图6)。
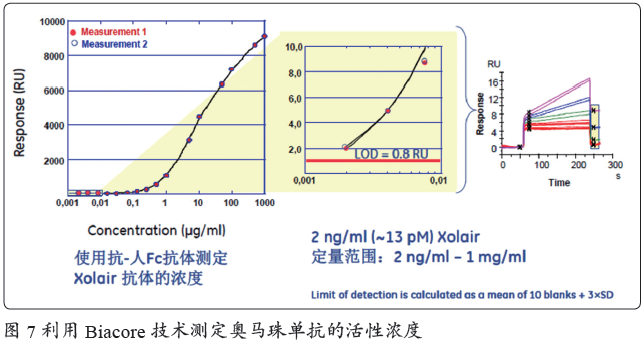
蛋白总浓度并不能反映药物的有效浓度, 活性浓度才是影响药效的关键指标。Biacore 活性浓度定量方法精度高、线性好,得到了众多用户的青睐。例如, 诺华的奥马珠单抗采用了Biacore 技术作为其工艺浓度控制的手段(图7)。
翻译后修饰对于维持抗体的正常结构和功能至关重要, 是质量控制中的关键一环。利用Biacore 技术可以比较不同翻译后修饰前后对抗体生物活性和稳定性的影响,如糖基化、脱酰胺化等。
小结
Biacore 分子互作技术除了在以上抗体筛选、生物活性、一致性评价和质量控制中的应用外,在表位分析、抗体改造、免疫原性等环节也发挥着巨大作用。Biacore 技术符合GxP 和21 CFR Part 11 法规的要求,其准确稳定的数据质量已经得到了药企和监管机构的广泛应用和认可,能够为加快抗体药物上市保驾护航。






加载更多