制药企业计算机化系统验证与实施
从东富龙多年计算机化系统咨询与验证实施经验讲,国内大多药企扔停留在观望状态,其实这是一种抱有侥幸的心理,殊不知这种高枕无忧的日子已经结束,近几年不管是国外还是国家药监局的飞检,重灾区依然是QC实验室,但目前也有往生产药机设备检查的趋势,同时开出的缺陷项必有一项涉及到数据完整性方面,内容不外乎数据造假、恶意篡改或删除数据、预进样、数据未有效备份或电子签名等等。计算机化系统的验证也许看起来非常的高、大、上,其实在过去的设备验证过程中,一系列的验证文档包括URS、FDS、HDS、SDS、DQ、IQ、OQ、PQ、RAR、RTM、VSR等等都是相辅相成,共同点是相通的,很多计算机化系统的验证活动在我们设备的验证过程中已经包含,但是仔细再看,做的却层次不齐,不够深入,一个“符合要求”,“符合规定”就“完美的”解决了验证,其实法规要求我们去展现的是整个过程,这一点也正是我们绝大数药企做的不够深入的。再者,对于我们制药人,要学会对现有系统分类,根据分类结果与验证V模型,针对性的拆解系统模块,可以从业务层面、也可以从GMP数据关联方面,形成每个模块需要验证的重点功能点与次要功能点,但需要明确的是对于Part 11及药政法规要求的功能:审计追踪、用户访问、权限分级、电子签名、数据备份等要严格的深入的进行系统测试。这一点也是毋庸置疑的,也是药监局检查的重点。
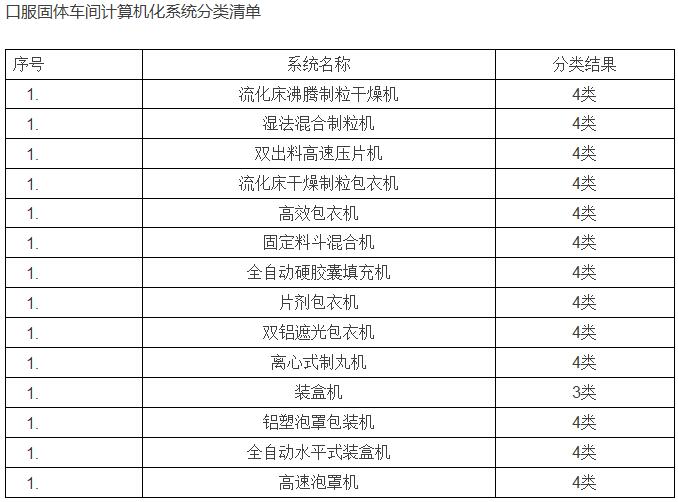
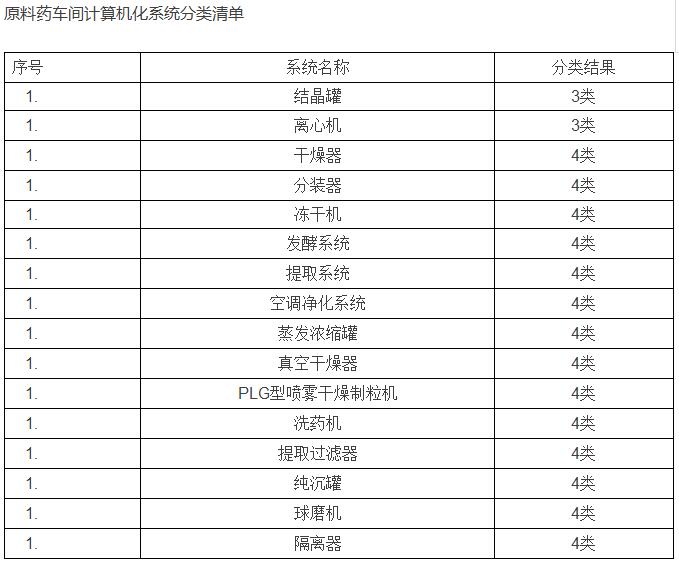
那么我们如何来进行计算机化系统验证,首先,我们需要确定哪些是属于需要验证的系统和设备。对于具体系统验证的测试项目无论系统大小、复杂程度、成熟程度均应根据制药验证的原则,验证项目根据系统与GxP的关联程度与作用。运用SIA(系统影响性评估)评估系统对法规符合性和研发、生产、销售等环节对患者安全、产品质量安全和数据完整性的影响。根据评估的结果确认是否对系统进行完整的验证或是简单的检查。例如:
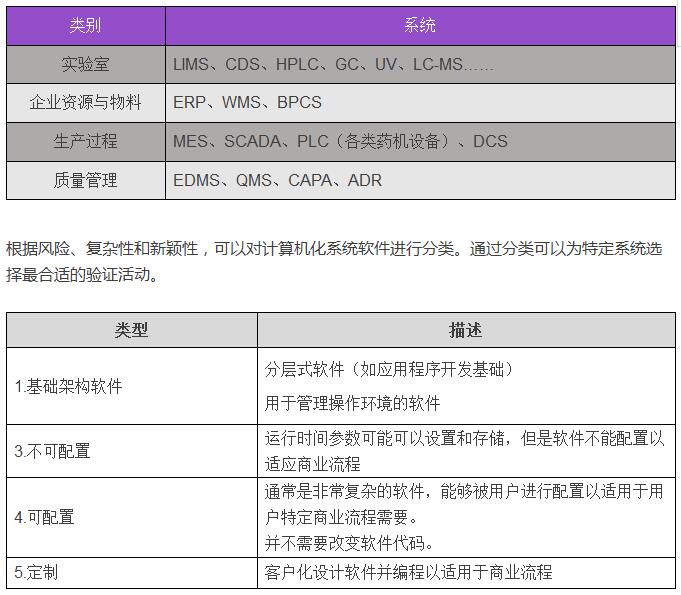
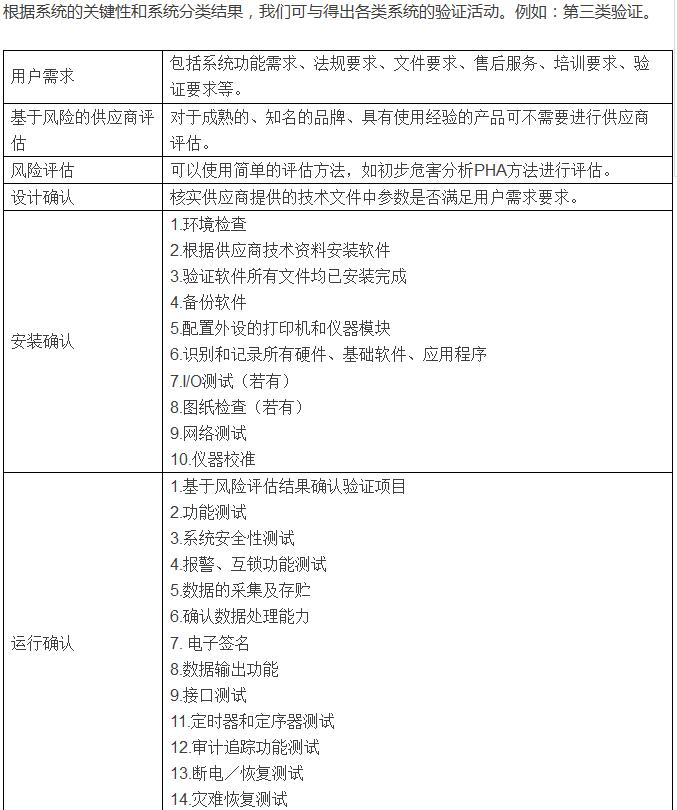

在确认系统类型属于哪一类验证活动后,将会进行验证活动,验证流程依据下面的流程图进行:
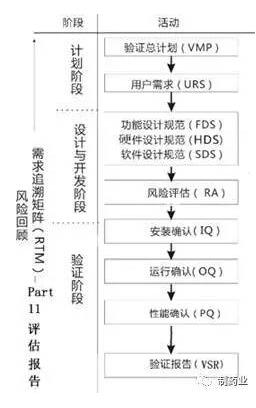
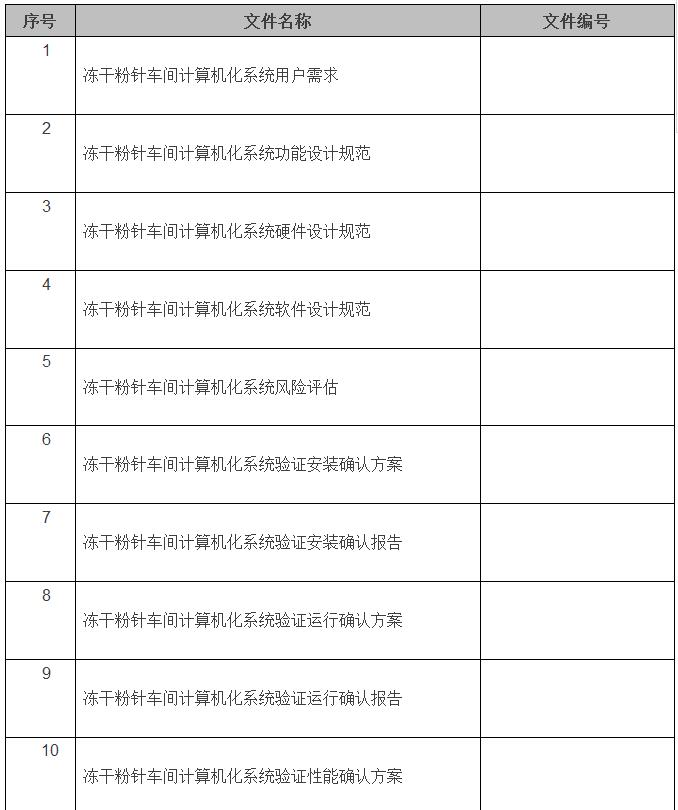
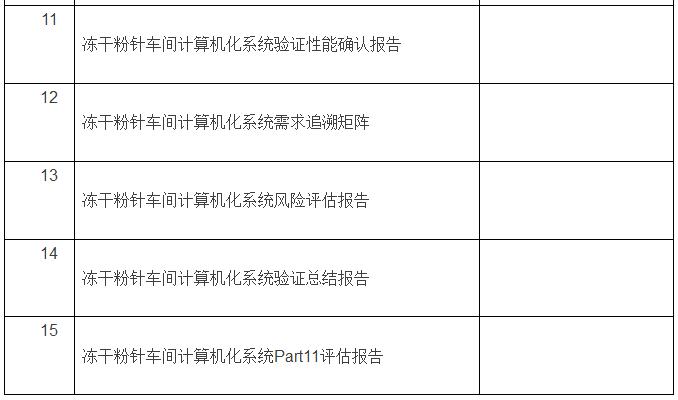
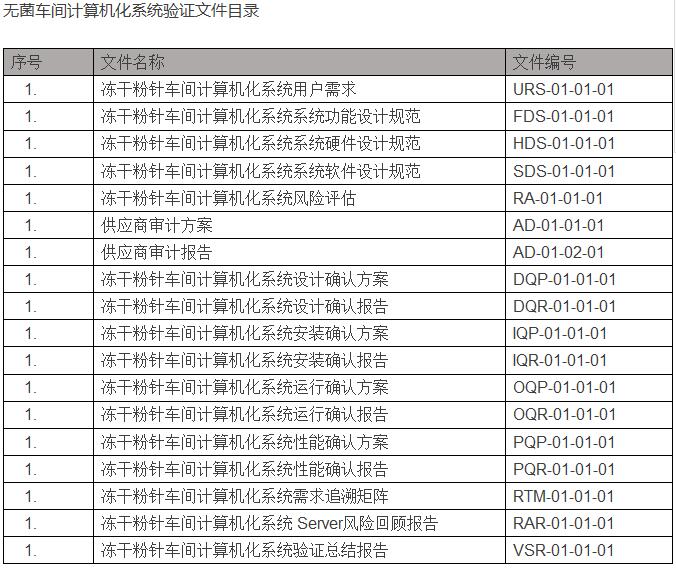
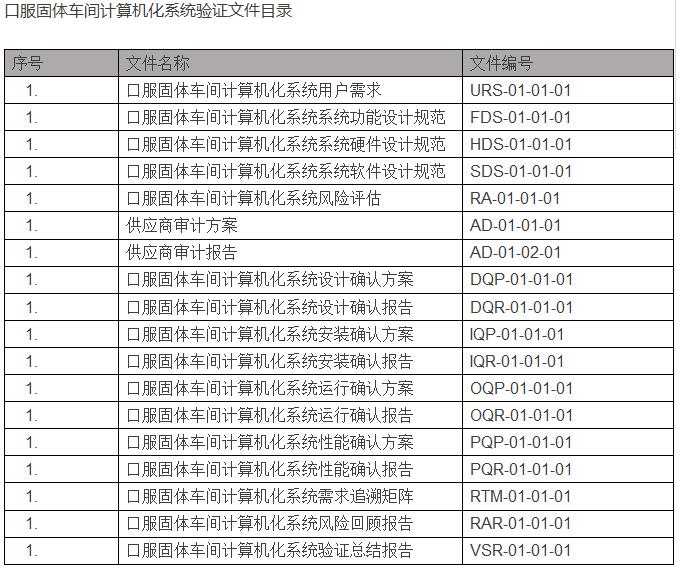
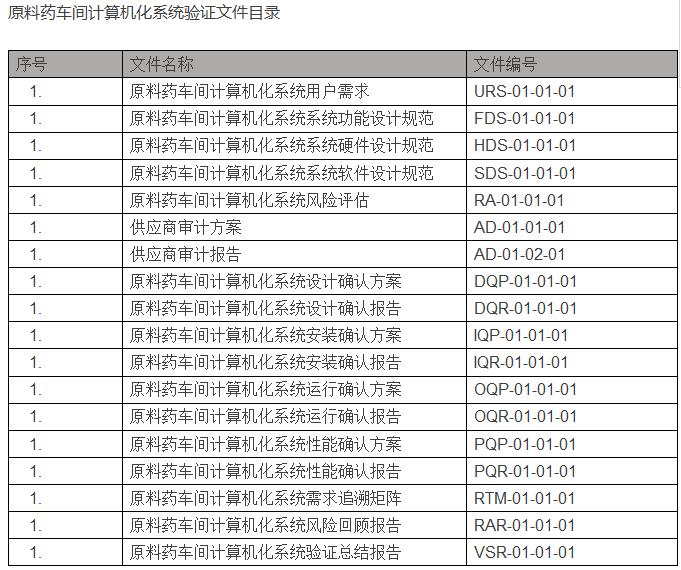
在验证完成后,结合计算机化系统验证范围情况,交付文件目录如下:(以冻干粉针车间为例)
在首次验证完成后,应当通过相关程序的控制,确保药企使用的计算机化系统维持持续的验证状态。相关的支持性程序包括但不限于以下:
●偏差处理
●变更控制
●培训与考核
●校准
●预防性维护
●再验证
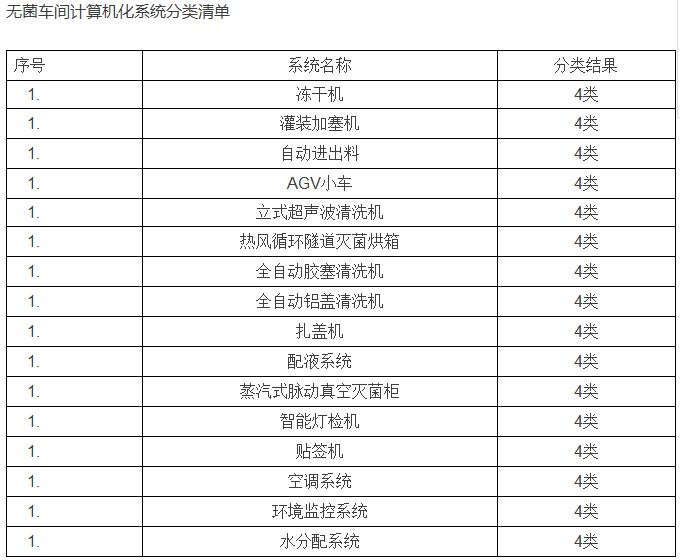
案例:
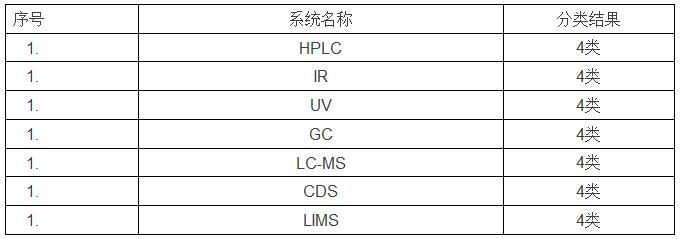
QC实验室计算机化系统分类清单
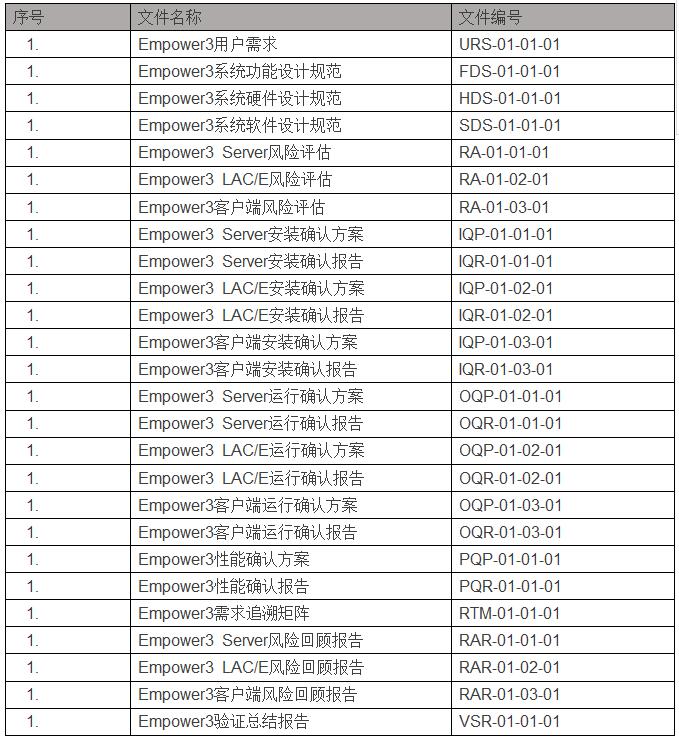
实验室验证文件目录(Empower3)







加载更多