欧盟新的药品防伪技术规范
欧盟防止药品假冒伪劣的技术规范(EU 2011/62/EU)规定:建立整个欧洲引进药品真伪验证系统以及药品包装物标准化的防伪识别标志——药品生产企业投入了上百万的资金,假冒伪劣药品始终是全球药品市场中的一大难题。这一新的欧盟条例给药品生产厂家带来了哪些新要求?又增加了多少生产成本呢?
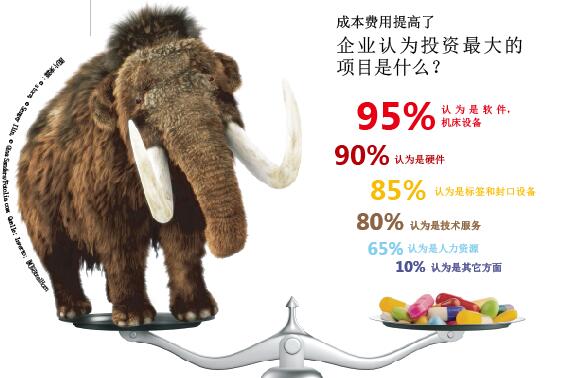
贯彻落实欧盟药品防伪技术这一巨大的猛犸象项目在等待着药品生产企业.
新的欧盟药品防伪技术规范应把药品供应链中的药品假冒伪劣降低到最低程度,从而也提高患者服药的安全性:从2019年2月份起,许多处方药的每一个包装都要有非常清晰、准确的防伪序列号。药品生产厂家将这些序列号登记在药品防伪验证系统中,在药品销售点,例如在各个药店中,当用户输入这些序列号之后系统就会注销这一序列号编号。这也就完成了从生产制造直至最终用户手中的一个供应链循环,也为供应链中的每一个参与者提供了验证药品真伪的可能性。
实施运作
采购和供应链管理咨询公司Inverto在线调查的结果表明:德国和奥地利大多数的制药生产厂(82%)都已经开始着手欧盟药品防伪技术规范的贯彻落实了。在被调查的企业中,包括了药品生产企业、全球化的药品出口商和德国的药品包装生产厂。总体上讲,药品生产企业已经充分了解了欧盟法规的要求。甚至有18%的被调查企业已经全面的贯彻落实欧盟防伪技术规范的要求了。
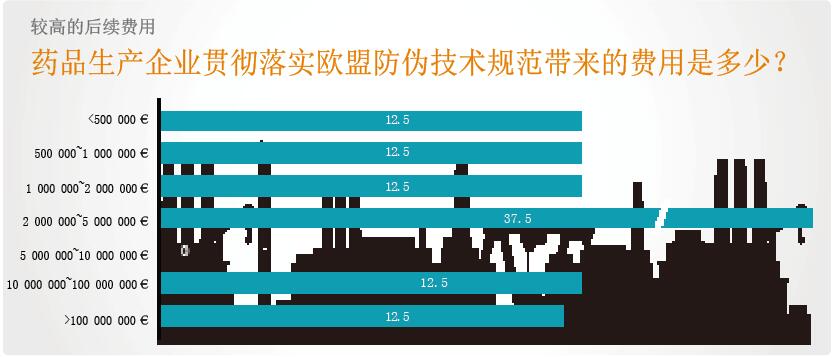
被调查企业希望贯彻落实新法规的投资额度在百万欧元左右。51%的被调查企业希望投资额在1百万~5百万之间,13%的给出了1千万~1亿欧元的范围,还有13%的估计会超过亿元欧元。只有26%的企业期望投资额不超过百万大关。
被调查企业给出的、一次性投资的详细情况如下:估计大约80%的投资用于设备,20%的投资用于IT系统。但企业也考虑到了这笔投资的后续费用,例如专利费、机床设备维护保养费用的提高和特殊序列号标签的费用等。另外,他们还希望增加的成本费用会纳入到药品生产过程的价值增值链中去,尽管这一点目前还很难预测。总之,有68%的被调查企业希望如此。
据预测,生产成本的提高主要是因为数据管理的复杂性提高了,IT系统的维护保养费用增加了。但生产过程和物流过程复杂性的提高、也明显的增加了所需的资金费用。除了生产成本和投资费用的增加之外,由专业软件、专用的序列号标签、机床设备维护保养和配件采购所带来的费用也都要计算进去。此时,开始时生产成本的提高与生产线较低的效益之间有着明显可以感觉到的差异;正像一些企业所报道的那样。另一个必须特别注意的问题就是要及时的贯彻落实。对于首次引进一个通用的、企业级的序列化解决方案,制药工业企业要做好耗时1~2年的思想准备。这是因为它的IT接口复杂性、软件供应商有限的研发生产能力、机床设备较长的供货期、市场中可以IT设备较长的研发期以及企业内部可用人员的紧缺等都是一些巨大的挑战。
Octapharma公司的项目负责人Daniel Pawella先生认为最大的挑战是IT系统的建成,他说:“许多外部企业都同时卷入到不同程序之间大量的接口技术问题中来了。”值得推荐的是,在实施通用的序列化解决方案的第一步工作中就寻找市场中已有的、能够灵活、快速投入使用的类似解决方案。这样,制药企业在开辟新市场领域时贯彻落实防伪技术规范后续项目的持续时间就会缩短到一个月至两个月;因为只需对IT系统进行一些适当的调整就可以了。
小结
尽管贯彻落实欧盟防伪技术规范会给企业带来一定的工作量、增加一些投资,但它也提供了优化企业经营过程和生产过程的机遇。
本文作者系科隆Inverto采购和供应链管理咨询公司负责人。







加载更多