基于国际法规的药品含量均匀度评价
对于面向国际的植物药产品开发,其工艺评价指标的设计必须符合国际法规需求——本文以含量均匀度、装量(或重量)差异这2个关键的制剂工艺评价指标为例,阐述如何依据国际法规来设计植物药工艺评价指标。首先,对中国、美国、欧洲三国药典关于含量均匀度、装量(或重量)差异的规定进行对比解析,之后以某植物药胶囊制剂作为案例,评价现行含量均匀度、装量差异指标与国际法规的符合性,并且依据国际法规对现行指标的完善提出建议。
近年来,全球植物药市场蓬勃发展。无论FDA植物新药注册,还是欧盟传统植物药注册,均遵循同样的药品评价原则:安全、有效、质量一致。植物药质量控制是一个复杂的体系,FDA植物药指南提出,植物药产品质量不能仅通过终产品检验来保证,更需要对工艺过程全程的监测和控制[1]。因此,对于植物药生产工艺设计合理的评价指标,对质量可控性非常重要。面向国际化的植物药工艺评价指标设计,首要条件就是符合国际法规要求。
植物药制剂的制备过程通常都包括将各种原、辅料混合均匀的工艺过程,对于固体制剂、半固体制剂和非均相液体制剂,必须采用含量均匀度、装量(或重量)差异等评价指标来控制批次内产品均匀性。中国药典(ChP)[2]、美国药典(USP)[3]、欧洲药典(EP)[4]均相继规定了含量均匀度、装量(或重量)差异检查法。本论文以硬胶囊剂的含量均匀度、装量(或重量)差异这2个关键的制剂工艺评价指标为例,通过对各国药典规定的深层解析,阐述如何保障植物药工艺评价指标与国际法规的符合性。首先,解析ChP、USP及EP在硬胶囊剂含量均匀度及装量(或重量)差异方面的规定;接下来,以1个硬胶囊剂产品的现行标准为案例,通过比较其与药典规定的异同点,评价现行标准与法规标准的符合性;最后,以药典为依据,评价现行标准合理性,为完善现行标准提供法规支持。
ChP、USP及EP含量均匀度及装量(重量)差异规定解析
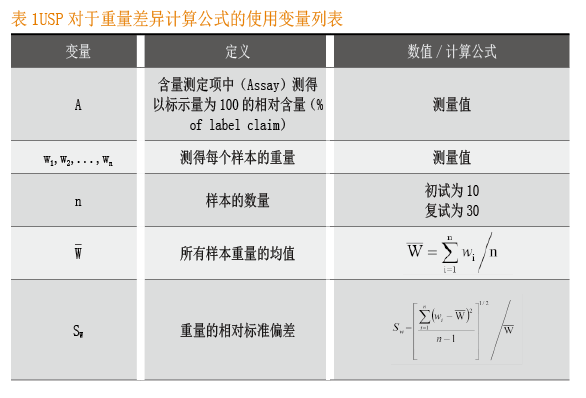
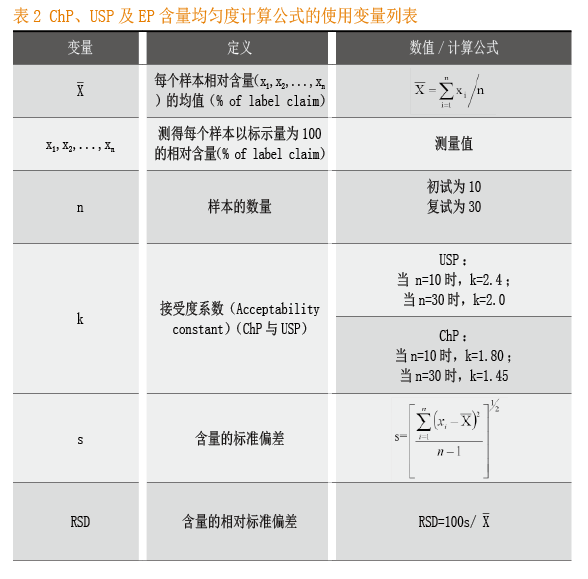
计算公式变量列表
在下述装量(或重量)差异及含量均匀度的计算过程中使用的变量见表1和表2,表中列出了变量名称、定义、数值或计算公式。
ChP装量差异与含量均匀度规定
装量差异
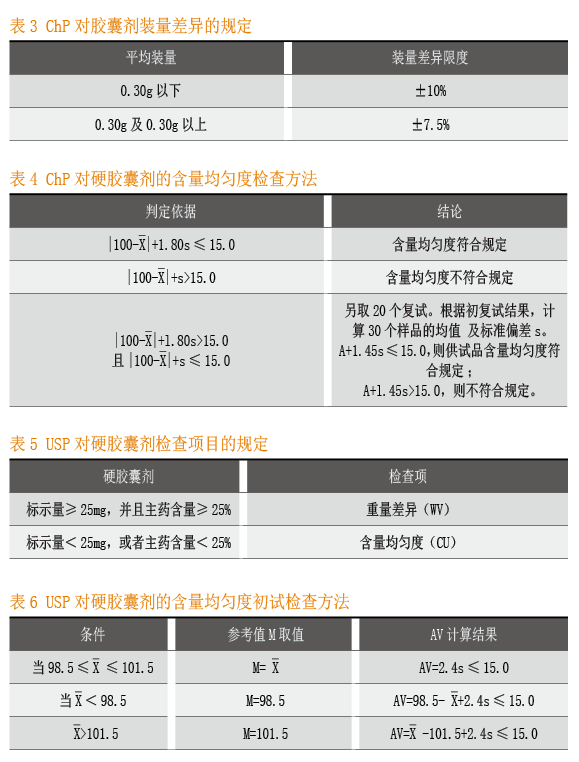
ChP对胶囊剂装量差异的要求见ChP2010版二部附录Ⅰ E胶囊剂。
取供试品20粒,分别精密称定胶囊重量及囊壳重量,求出每粒内容物的装量与平均装量。每粒装量与平均装量相比较,超出装量限度的不得多于2粒,并不得有1粒超出限度1倍。
凡规定检查含量均匀度的胶囊剂,一般不再进行装量差异的检查。
含量均匀度
在将各种原辅料混合均匀的工艺过程中,当一个单剂中主成分或复方制剂中某个主成分绝对量较小或主成分在整个处方中所占比重较小时,主成分与其它成分及辅料混合均匀的难度增加,可能导致批产品的不均匀。因此,对于单剂量所含有效成分仅数毫克或更少的固体制剂,仅靠控制重量(或装量)差异难以保证单位剂量的准确。1965年,USP6第ⅩⅤⅡ版首次规定了含量均匀度检查法,此后,中、日、英等国也相继在本国药典中规定了含量均匀度检查。
ChP对胶囊剂含量均匀度的要求见ChP2010版二部附录Ⅹ E含量均匀度检查法。硬胶囊剂,每个标示量不大于25mg或主药含量不大于每个重量25%者,应检查含量均匀度。
取供试品10个,分别测定每个样品的相对含量xi,计算平均含量 及标准偏差s。
标示量与均值之差的绝对值为|100-X |。
接受度(Acceptance Value,AV)的计算公式为:AV=|M-X|+ks 。
含量均匀度判定依据列于表4。
USP重量差异与含量均匀度规定
USP关于重量差异及含量均匀度的规定见USP 37 <905> Uniformity of Dosage Units。对于硬胶囊剂,每个标示量不小于25mg且主药含量不小于每个重量25%者,检查重量差异;而对于每个标示量小于25mg或主药含量小于每个重量25%者,需检查含量均匀度。
含量均匀度(Content uniformity)
取供试品10个,分别测定每个样品的相对含量xi,计算平均X含量 。
接受度(Acceptance Value,AV)的计算公式为:|M-X|+ks 。
初试满足含量均匀度,对AV取值的要求列于表6。
当以上条件不被满足时,复试。复试时,另取供试品20个,分别测定每个样品含量,与初试的10个合并统计,计算平均含量 及标准偏差s。接受度AV的计算公式仍旧为:|M-X|+ks ,但是接受度系数k调整为2.0。此外,每个样品以标示量为100的相对含量需符合: 0.75M≤xi≤1.25M。满足条件判定为含量均匀度符合规定;否则判为不符合规定。
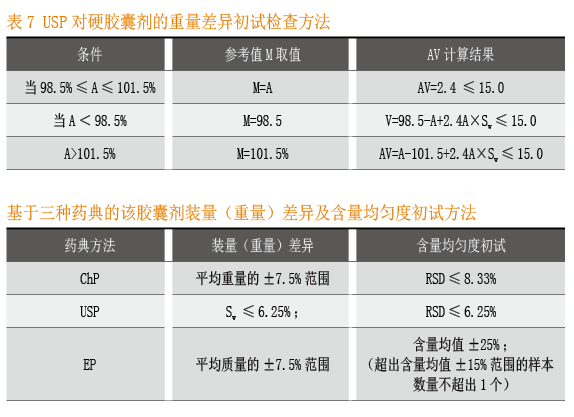
重量差异(Weight variation)
取供试品10个,分别测定每个的重量 ,计算所有样本的平均重量 。基于Assay含量测定值A及重量值,计算每个样本相对含量的估计值(% of label claim) ,计算公式如下:
xi=wi×A/W
由此,对于重量差异的检查转化为对于含量估计值均匀度的检查,接受度(acceptance value,AV)的计算公式及判定标准与USP项含量均匀度检查方法完全相同。
所有样本含量估计值的均值 的计算公式为:
标准偏差
由此AV计算公式转化为:
AV= |M-X|+ks = |M-A|+k ×A×SW
初试满足含量均匀度,对AV取值的要求列于下表:
当以上条件不被满足时,复试。复试时,另取供试品20 个,
分别测定每个重量 ,与初试的10个合并统计,计算平均含量 及标准偏差 。接受度AV 的计算公式仍旧为:|M-A|+k ×A×SW ,但是接受度系数k 调整为2.0。此外,每个样品以标示量为100 的相对含量均需符合: 。满足条件判定为含量均匀度符合规定;否则判为不符合规定。
EP质量均匀度与含量均匀度
EP关于质量均匀度的规定见EP 8.0 2.9.5 ,关于含量均匀度的规定见EP 8.0 2.9.6 。
质量均匀度(Uniformity of Mass)
EP与ChP对于胶囊剂装量(质量)差异的要求完全相同。
含量均匀度(Uniformity of Content)
取供试品10个,分别测定每个样品的相对含量xi,计算平均含量X 。
1)当满足以下两个条件时,含量均匀度符合规定:所有样本含量需满足 75%X≤xi≤125%X;含量超出[85%,115%]范围的样本数量不超出
1个。
2)当以下任一情况发生时,含量均匀度不符合规定:含量超出[85% ,115% ]范围的样本数量超出3个;1个或更多样本的含量超出[75% ,125% ]范围。
3)如果所有样本含量均满足 ,并且含量超出[85% ,115% ]范围的样本数量为2~3个,则另取供试品20个,复试。
复试时含量均匀度需满足两个条件:所有样本含量需满足 75%X≤xi≤125%X;含量超出[85% ,115% ]范围的样本数量不超出3个。否则,复试的含量均匀度不符合规定。
三种药典方法的比较评价
现行的含量均匀度检查方法可分为非参数型(计数型)和参数型(计量型)。计数型检查法,是从批产品中抽取一定数量的样本,逐个测定其含量,如果偏离参考值(标示量或测定值的平均值)某一限度的样本超过某一数目,则判定该批产品含量均匀度不合格。计量型检查法,是根据样本的含量平均值和标准偏差等统计参数评价批产品的含量均匀度。两种方法相较而言,前者易受1~2个含量超限样本的影响,容易忽略绝大多数单剂含量如何接近标示量的事实。后者是根据样本中全部单剂的含量,采用统计量来估计样本总体分布情况,统计学依据更强,同时计量法具有减免化验方法随机误差对含量均匀度检查影响的优点[5,6]。
USP与ChP均采用了计量型检查法,依据含量测定值的均值和标准偏差统计量,来对各样本含量的分布情况进行分析。USP初试与复试的接受度系数为2.4和2.0,ChP初试与复试的接受度系数为1.8和1.45,USP比ChP较为严格。
EP采用计数型检查方法,USP同时也采用计数型方法,基于规定数量的单剂量各样本的含量测定值与其各样本含量平均值或标示量的比较,根据其超出限度的样本个数进行判定。不同的是,USP以标示量为参考值,EP以标抽样样本的均值(X)为参考值,在均值与标示量差异较大时,即使以均值作为参考值的样本含量离散度不高,仍旧可能出现判定准确性不高的结果。
案例分析
某植物药硬胶囊制剂,胶囊装量为1.0g左右,含量均匀度检查指标为某化学标记物,CM。依据3种药典,得到该植物药制剂装量(或重量)差异及含量均匀度的制定依据。对于依据ChP、USP的含量均匀度指标,进行下述推算。
以ChP为依据的含量均匀度
对于该胶囊剂,以“提取物整体”作为质量控制指标,对于化学标记物没有绝对含量的标示量要求。10个供试品成分CM的含量测定值均值为 ,即以 为标示量,|100-X |=0。接受度AV计算为:
AV =ks =k×100×RSD≤15
依据表4的ChP含量均匀度检查方法,该胶囊剂的含量均匀度初试判定方法为:RSD≤8.33%,则符合规定;RSD>15%,不符合规定;8.33%
以USP为依据的含量均匀度
同上所述,该胶囊剂对于化学标记物没有绝对含量的标示量要求,因此以Assay含量测定值A作为标示量的100%。依据表7的USP重量差异检查方法,初试方法为:
AV= 2.4A×Sw≤15.0=2.4 ×100×Sw≤15.0,即 Sw≤6.25%
若不满足以上条件,需另取20个复试。
接受度系数调整为2.0:
AV= 2A ×Sw≤15.0=
2 ×100×Sw≤15.0,即 Sw≤7.5%
此外,相对含量估计值需符合: 0.75A≤xi≤1.25A,即每个样品以标示量为100的相对含量估计值落在75%~125%范围内。
以成分CM计,每个标示量小于25mg并且主药含量小于每个重量25%,需检查含量均匀度。以供试品成分CM含量测定值的均值 为标示量,即 X=100,此时M=100, |M-X|=0,s=100×RSD。接受度AV计算如下:
AV=A+ks= ks=100×k×RSD≤15%
依据表6中USP对硬胶囊剂的含量均匀度初试检查方法,初试满足含量均匀度的条件为:
100×2.4×RSD≤15.0,即RSD≤6.25%。
若RSD>6.25%,则另取20个需复试。复试需满足两个条件:
1)100×2.0×RSD≤15.0,即RSD≤7.5%;
2)每个样品以标示量为100的相对含量均需符合: 0.75M≤xi≤1.25M,即每个样品以标示量为100的相对含量落在75%~125%范围内。
现行标准符合性分析
假定该胶囊制剂现行标准为:装量差异±7.5%,含量均匀度RSD≤5%(n=10)。装量差异标准与ChP及EP要求完全相同。现行含量均匀度(RSD≤5%)标准严于ChP及USP标准;依据EP,可以考虑增加计数型标准:所有样本的含量不超出平均含量±25%,并且含量超出平均含量±15%范围的样本数量不超出1个。
结语
本文对中国、美国、欧洲三国药典关于硬胶囊剂的含量均匀度及装量(或重量)差异检查方法进行了深度解析,以某植物药胶囊制剂作为案例,阐述了如何依据不同药典规定来制定相应检查指标,还对该植物药的现行标准与三个药典规定的符合性进行了分析。本文研究流程同样适用于其它剂型的含量均匀度、装量(或重量)差异检查的法规解析。面向国际的植物药产品开发,在设计产品工艺质量的评价、控制指标时,首先就应充分考虑各国注册法规的具体要求,针对注册国家的不同,完善产品原有评价指标,保障其符合或优于法规要求。
[参考文献]
[1] Guidance for industry: Botanical drug products. Food and Drug Administration, Rockville, MD, USA, 2004.
[2] 中国药典2010版二部附录Ⅰ E胶囊剂.附录Ⅹ E含量均匀度检查法.国家药典委员会,北京, 2009.
[3] USP 37-NF 32 <905> UNIFORMITY OF DOSAGE UNITS. The United States Pharmacopeial Convention, Rockville, Maryland, USA, 2013.
[4] EP 8.02.9.5.UNIFORMITY OF MASS OF SINGLE-DOSE PREPARATIONS.EP 8.02.9.6. UNIFORMITY OF CONTENT OF SINGLE-DOSE PREPARATIONS.European Directorate for the Quality of Medicines & HealthCare, Strasbourg, France, 2013.
[5] 徐万魁.中、美、日含量均匀度检查方法的比较与新方案初探.沈阳:沈阳药科大学,2008.
[6] 陶巧凤.含量均匀度检查方法的比较与评价.中国药品标准, 2005, 6(4): 32.






加载更多