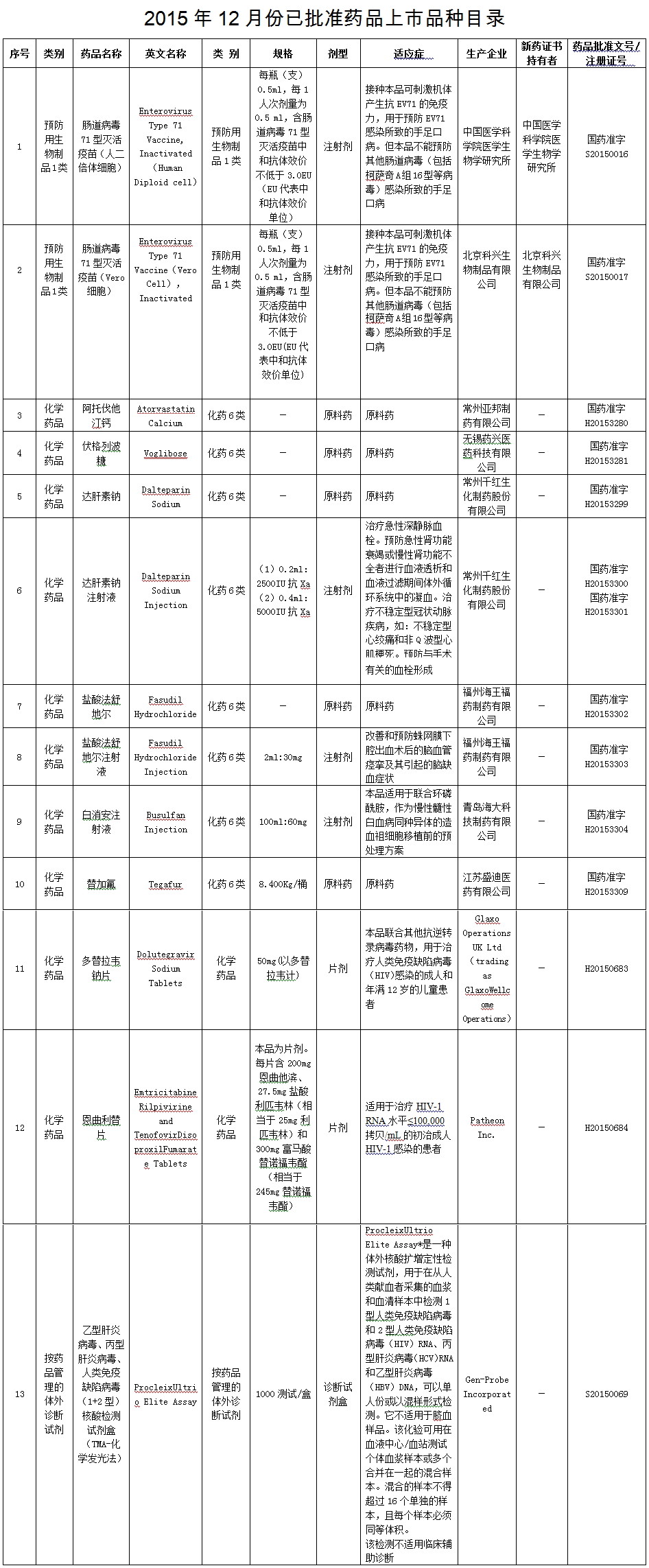
CFDA:近期批准13个药品,包括1款体外诊断试剂

2015年12月份共批准药品上市申请13件,其中,国产化学药品8件,生物制品2件;进口化学药品2个,体外诊断试剂1件(品种目录见附件)。
2款生物制品
12 月3日,CFDA批准全球首个肠道病毒71型灭活疫苗(人二倍体细胞)生产注册申请。该疫苗的问世,对于有效降低我国儿童手足口病的发病率,尤其是减少该病的重症及死亡病例,保护我国儿童生命健康具有重要意义。中国医学科学院医学生物学研究所自2008年开始EV71灭活疫苗的研发工作,在国内外尚无同类疫苗研发上市的情况下,突破了疫苗二倍体细胞规模化生产和质量控制关键技术瓶颈。临床试验结果显示,该疫苗安全性较好,对EV71引起的手足口病的保护率可达97.3%
肠道病毒71型灭活疫苗(Vero细胞)是一种由中关村高科技企业科兴生物自主研发的疫苗,经过8年的研发攻关,中关村高科技企业科兴生物自主研发的肠道病毒71型灭活疫苗日前获得国家食品药品监督管理总局批准的生产注册申请,并取得新药证书和药品注册批件,有望于1月底启动生产,并于2016年二季度末正式上市。
1款诊断试剂
从FDA批准的体外诊断试剂来看,仅为一家,是总部设在美国圣地亚哥市的Gen-Probe公司(豪洛捷),该公司开发全球快速、精确、高效分子诊断产品及服务业的开发、制造及销售,其产品重点用于疾病诊断、血液筛查,并确保移植兼容性,以期通过早期检验筛查,提高早期诊断和微创治疗水平,及时挽救生命。
此次被批准的乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒(1+2型)核酸检测试剂盒是基于TMA-化学发光法研发而成;属于按药品管理的体外诊断试剂;ProcleixUltrio Elite Assay*是一种体外核酸扩增定性检测试剂,用于在从人类献血者采集的血浆和血清样本中检测1型人类免疫缺陷病毒和2型人类免疫缺陷病毒(HIV)RNA、丙型肝炎病毒(HCV)RNA和乙型肝炎病毒(HBV)DNA,可以单人份或以混样形式检测;它不适用于脐血样品。该化验可用在血液中心/血站测试个体血浆样本或多个合并在一起的混合样本。混合的样本不得超过16个单独的样本,且每个样本必须同等体积。且该检测不适用临床辅助诊断。






加载更多